Si-Click® – (kupfer-freie) Click-Chemie
Die Click-Chemie ist eine Klasse von chemischen Reaktionen zwischen zwei reaktiven Substanzen, die mit hoher Effizienz und Spezifität ablaufen, ohne dass spezielle Lösungsmittel oder Katalysatoren nötig sind. Diese Eigenschaft kann man sehr gut zum Labeln von Proteinen in intakten Zellen nutzen: man kann die gelabelten Proteine in ihrer natürlichen Umgebung beobachten und verfolgen, und man kann wichtige Erkenntnisse bezüglich der Zellbiologie gewinnen – auch hinsichtlich einer möglichen Wirkstoffentwicklung.
Heute existieren verschiedenste Ansätze für das Protein-Labeling, die sich in der Größe der Modifikation, dem generellen Anwendungsbereich und der Benutzerfreundlichkeit unterscheiden.
Ein großer Nachteil vieler genetisch codierter Tags ist ihre Größe; diesen Nachteil kann man überwinden, indem man einzelne Aminosäuren mit kleinen Farbstoffmolekülen kennzeichnet.
Die neuen L-Lysin-basierten Verbindungen haben Cyclooctin-(z.B. SCO / BCN), trans-Cycloocten (z.B. TCO-4-en / TCO*) oder Propargyl-Einheiten (z.B. PrK), die in Proteine – unter anderem von E. coli und Säugerzellen – eingebaut werden können.
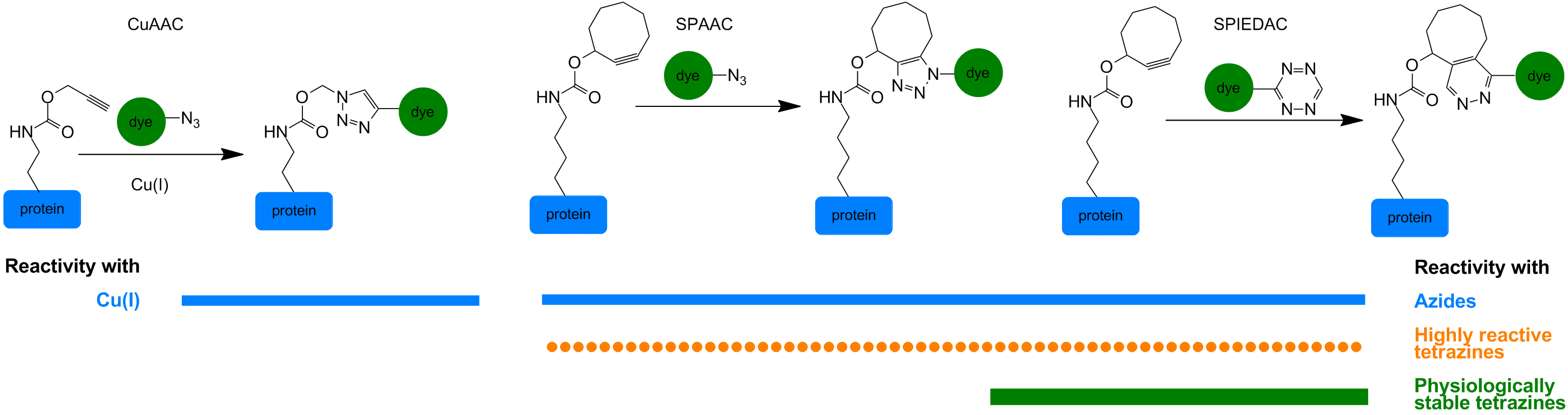
Kupfer (I)-katalysierte (Copper(I)-catalyzed Azide-Alkyne Cycloaddition / CuAAC) Click-Chemie zwischen Aziden und linearen Alkinen und die beiden stärksten Vertreter von in vivo bioorthogonalen chemischen Reaktionen, strain-promoted alkyne-azide cycloaddition (SPAAC) und strain-promoted inverse electron-demand Diels-Alder cycloaddition (SPIEDAC) können dazu verwendet werden, effizient und schnell Fluorophore konjugiert zu Azid- und Tetrazin-Einheiten anzubringen.
Durch diese modulare Technik kann jede denkbare Probe -gekoppelt an eine Azid- oder Tetrazin-Einheit – an jedes Protein mit einer entsprechenden unnatürlichen Seitenkette angebracht werden.
Die gespannten Ringe (Cyclooctin, trans-Cycloocten) finden auch Anwendung beim schnellen Freisetzen von Wirkstoffen: Die Click-Reaktion und damit die gezielte Spaltung von tumorgebundenen Antibody–Drug Conjugates (ADCs) kann ein leistungsfähiges Tool in der ADC-Therapie sein.
Eine weitere Verwendung finden die Click-Reagenzien in der Oberflächenplasmonenresonanz (SPR: Surface Plasmon Resonance) – einer weit verbreiteten Methode zur Charakterisierung von Bindungen z.B. zwischen kleinen Molekülen und Zielproteinen. Hierbei werden die Sensoren und die Liganden (z.B. Proteine) mit entsprechenden Click-Tools versehen und können so quantitativ und äußerst selektiv miteinander regieren.
Entsprechende Tools finden Sie hier: SiChem_PEG-tools oder im Shop
…wenn es um größere Mengen geht
SiChem entwickelt entsprechende Click-Aminosäuren mit unterschiedlichen Substituenten und (PEG)-Linkern oder Farbstoffen nach Ihren Vorgaben. Mengen im kg-Massstab können in unseren gut ausgestatteten Laboren in hoher Reinheit hergestellt werden.
Auch entsprechende Vorstufen, wie verschiedene Aktiv-Ester und Alkohole mit gespannten Ring-Systemen können in größeren Mengen synthetisiert werden.